Fermiones, bosones, quarks, leptones, antimateria, estados cuánticos, el Higgs (o mejor dicho el BEH)… Supongo que también os habréis percatado de que últimamente, y sobre todo después del hallazgo del bosón de BEH (Brought-Englert-Higgs) el año pasado, los medios están inundados con referencias a partículas elementales y al modelo estándar, la física actual que nos explica de que está formada la materia y cómo interactúan sus componentes. Pero, ¿cómo empezó todo?
De qué está compuesta la materia es una de las preguntas más viejas que deben existir. Ya en la Grecia clásica, en el s. V a. C., Leucipo y su alumno Demócrito intuyeron que la materia debía estar constituida por partículas indivisibles a las que llamaron átomos (ἄτομος). Yo no sé qué clase de fungi psicotrópicos consumían por aquella época en Elea porqué, al fin y al cabo, no iban muy erradas sus ideas…y eso que sus coetáneos no les hicieron mucho caso. En fin, el hecho es que este concepto de indivisibilidad permaneció dormido hasta que John Dalton, a principios del siglo XIX, lo recuperó. Su modelo atómico, semejante a una esfera infinitesimal (para los de la LOGSE: muy pequeña) e indivisible, supuso toda una revolución en la época. Con este modelo se conseguía explicar en base a unos postulados sencillos gran parte de la química de la época. A pesar de sus limitaciones, el modelo de Dalton consiguió una gran aceptación entre la comunidad científica y permaneció vigente casi 90 años hasta que otro físico, J. J. (José Juan o Joseph John) Thomson, consiguió demostrar empíricamente que el átomo sí que resultaba ser divisible.
Pero, ¿Cómo consiguió semejante hazaña? A finales de siglo XIX andaba el señor Thomson investigando la naturaleza de los rayos catódicos. Estos rayos son un tipo de radiación que emanan de una superficie metálica calentada eléctricamente (cátodo). Sobre ellos se discutía sobre si eran de carácter etéreo (ondas; y sí, todavia la idea del eter era bastante vigente) o corpuscular (partículas). Este problema resurgiría unos 30 años más tarde con la llegada de la mecánica cuántica, pero eso mejor lo dejamos para otro día, que si no me enrollo.
Bueno, por donde iba, ¡ah, sí!, Thomson y sus rayos. El éxito de Thomson residió en el desarrollo de la técnica necesaria para determinar si los rayos catódicos eran desviados por campos eléctricos. Esto punto es realmente crucial pues, en base a las leyes electromagnéticas de Maxwell (¡hay que ver lo bonitas y potentes que son!), una partícula cargada en movimiento debería responder a campos magnéticos y eléctricos y hasta la fecha los rayos catódicos parecían inmunes a estos últimos. Aquí abajo, en la figura 1, podéis ver la representación esquemática del tubo que utilizo para sus ensayos.
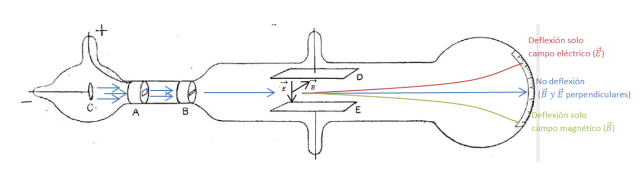 Figura 1. Esquema del tubo de rayos catódicos utilizado por Thomson en sus experimentos. A,B: colimadores conectados a tierra; C: cátodo; D,E: placas metálicas (5×2 cm) separadas por 1,5 cm. Extraído de J.J Thomson, ‘Cathode Rays’, Phil. Mag. 44,293 (1897).
Figura 1. Esquema del tubo de rayos catódicos utilizado por Thomson en sus experimentos. A,B: colimadores conectados a tierra; C: cátodo; D,E: placas metálicas (5×2 cm) separadas por 1,5 cm. Extraído de J.J Thomson, ‘Cathode Rays’, Phil. Mag. 44,293 (1897).
En él un chorro de iones se emite desde el cátodo (C) que, después de ser colimado (A,B), es obligado a pasar por dos campos perpendiculares, uno eléctrico (Ε), creado por las placas, y el otro magnético (B), creado por un electroimán no ilustrado (use the force, Lorentz), antes de chocar contra una capa de sulfuro de zinc. Esta capa es fluorescente, por lo que al chocar los rayos en ella brillaría permitiendo así realizar mediciones.
Como ya os podréis haber imaginado el montaje de Thomson funcionó y consiguió demostrar que los rayos catódicos también estaban influenciados por los campos eléctricos. Eso supuso poner fin a la discusión sobre la naturaleza de los rayos catódicos, determinando que su verdadera naturaleza era corpuscular, o al menos hasta que llegaron de Broglie y Young, y llamo a su recién descubierta partícula electrón.
¿Por qué funciono? El quid de la cuestión en el montaje de Thomson resulta ser el vacío. Sin él los rayos catódicos ionizarían a las moléculas del gas presente en el tubo y estas serían atraídas por las placas anulando así el campo eléctrico. Esta era la razón por la cual no había sido observada hasta la fecha ninguna influencia del campo eléctrico en los rayos catódicos.
Para determinar la influencia de los dos campos en el haz de rayos catódicos lo que hizo Mr. Joseph John fue algo sencillo pero efectivo: ¡sintonizó los campos de tal forma que su influencia total fuese nula y por tanto no desviasen el haz! Además, Thomson varió el campo magnético y midió la diferencia en el ángulo de incidencia del haz con respecto al que no era desviado (cf. Figura 1). Esto le permitió determinar la relación entre la carga eléctrica y la masa del electrón (q/m). Thomson se debió quedar bastante alucinado al ver que el valor que obtuvo era considerablemente más bajo que la de un átomo ionizado. Esto solo podía significar dos cosas, o bien que la carga de un electrón era más pequeña que la de un átomo o bien que su masa era más pequeña. Thomson también notó que los electrones tenían la habilidad de atravesar materia, lo que añadido a su pequeño ratio de carga-masa le indujo a pensar que el electrón debía tener una masa más pequeña que la de un átomo. Esto último le llevo a redefinir el modelo atómico de Dalton y postulo el suyo propio, el modelo atómico de Thomson. El átomo de Thomson ya no es indivisible y está formado por partículas más pequeñas de carga negativa embebidas en un átomo de carga positiva, también conocido como plum pudding model o modelo del budín de pasas.
Figura 2. Representación esquemática del modelo atomico de Thomson y un plum pudding o budín de pasas (fuente: Wikipedia).
Yo aquí me quito el sombrero y vitoreo, ¡Olé, olé y olé! ¡Ese es mi José y esto sí que es física de la buena! ¡No sólo has puesto fin a la discusión sobre la naturaleza de los rayos catódicos sino que has encontrado algo más pequeño que el indivisible atomo de Dalton, el electrón! Sí que te merecías el Nobel, sí.
Años mas tarde, ya en el siglo XX, utilizando el ratio carga-masa de Thomson y sus propios resultados, Millikan consiguió determinar la carga y la masa del electrón. Una de las consecuencias más influyentes de los resultados de Milikan fue que al determinar la carga del electrón puso la primera piedra en el mundo cuántico, pues postulo que toda carga eléctrica era resultado de la adición de una carga fundamental, la del electrón, (o sea q = n·e, siendo e la carga fundamental y n igual a +-1,2,3,…). El experimento de Millikan también se merecería otra entrada particular…
En fin, lo bueno no dura mucho y unos más tarde los experimentos de Rutherford conducirían a un nuevo modelo atómico y Louis-Victor de Broglie volvería a levantar sospechas sobre si la verdadera naturaleza del electrón es ondulatoria o corpuscular en base a los trabajos de Einstein y Planck.
¡Si te ha gustado la entrada no te olvides de compartirla!:)
Juan
No te pierdas la proxima entrada sobre materiales: ¿Tiene el grafeno algún competidor? Sígueme en @emececuadrado


Me encanta! Contextualizar la física en su marco histórico, cultural o social es una forma divertida de acercarla a todos los públicos. Conozco unos cuantos profesores que deberían adoptar algunas ideas de este blog. Enhorabuena! Espero tu próxima entrada